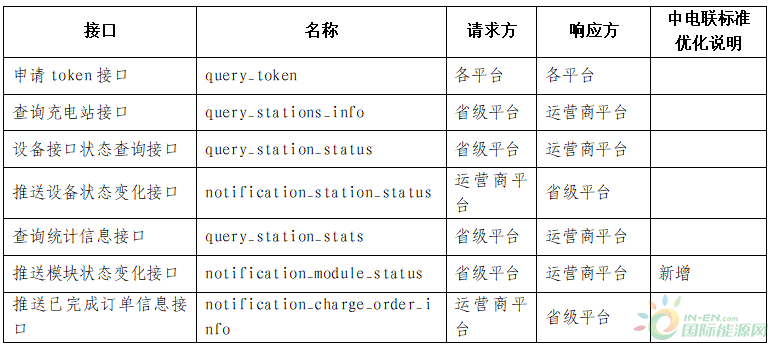
免疫检查点抑制剂的获得性耐药机制
前言
免疫检查点抑制剂(ICIs)的出现迅速改变了多种癌症的治疗模式,在过去的十年中,从2011年CTLA-4抑制剂在转移性黑色素瘤中的首次批准开始,到目前PD-(L)1抑制剂已经成为20多种不同癌症适应症治疗的常规手段。
这种显著的转变在很大程度上是由ICI带来的前所未有的缓解持久性所推动的,即使没有持续治疗,反应也可能持续数年。然而,除了在某些疾病中(例如黑色素瘤、默克尔细胞、霍奇金淋巴瘤、MSI-H肿瘤)的患者对单药PD-1阻断有较高的响应率(40%?70%)外,大多数其他癌症适应症的缓解率仅为10–25%。此外,即使在最初对ICIs有反应的患者中,疾病最终也可能进展。
对ICIs的耐药分为两大类:1)原发性耐药,通常指完全没有反应,而是迅速或最终进展为ICIs的患者;2)获得性抵抗,指的是患者对治疗有一段时间的初始反应,然后最终出现疾病进展。
目前应对原发性耐药,人们通常采用联合治疗,以扩大应答人群。例如,在肺癌、乳腺癌和胃癌ICIs与化疗的联合以及在RCC的多靶点TKIs和膀胱癌的FGFR抑制剂联合应用。此外,对于初始ICI反应的预测性生物标志物也已经进行了广泛的研究。PD-L1表达、肿瘤突变负荷、肿瘤浸润淋巴细胞(TIL)或相关基因表达特征已被探索为潜在预测因子,目前正在研究各种其他标记物。相反地,目前还没有被批准的治疗来规避或逆转获得性耐药,关于ICIs获得性耐药的特征或机制的研究也很少。
ICI获得性耐药的发生率
研究汇总了ICI在不同肿瘤临床研究的获得性耐药数据,可以明显看出,获得性耐药的比率在多种疾病类型中的表现有所不同。

更普遍地说,在不同的肿瘤类型中,PD-1抑制剂的总应答率与应答者获得性耐药的频率之间似乎呈反比关系。

ICI获得性耐药的机制
尽管许多病例有不确定或未知的机制,ICI的耐药机制大致可分为以下几类:1)抗原提呈机制缺陷;2)IFN-γ信号通路缺陷;3)新抗原丢失;4)肿瘤介导的免疫抑制;5)其它抑制检查点。

抗原提呈机制缺陷
T细胞介导免疫的激活依赖于抗原呈递细胞的主要组织相容性复合体(MHC)上抗原的识别,而β-2-微球蛋白(B2M)是负责稳定细胞表面的MHC 1类分子和促进抗原肽装载的关键基因。B2M功能缺失突变可导致MHC I缺失,导致肿瘤逃避免疫系统监视。此外,还有许多其它未知的基因或细胞因子可能调节MHC 1表达,从而影响对ICI的抗性。

IFN-γ信号通路缺陷
效应T细胞分泌IFN-γ通过JAK-STAT途径触发肿瘤细胞的信号级联,介导MHCⅠ和PD-L1表达,并可通过多种途径诱导肿瘤细胞死亡。在这一途径中,关键的第一步是通过IFN-γ与异二聚IFNGR1/IFNGR2的结合激活受体相关激酶JAK1和JAK2。最近的临床研究报告了JAK1或JAK2失活突变的病例,这些突变可能促进了ICI耐药性的进展。

新抗原丢失
新抗原特异性T细胞可能是ICIs发挥作用的关键驱动因素。因此,通过克隆选择、表观遗传抑制或拷贝数丢失,编码肿瘤特异性新抗原的体细胞突变的丢失可能导致随后的免疫逃避和临床进展。

肿瘤介导的免疫抑制
在临床前模型中,在PI3K活性调节中起关键作用的抑癌基因PTEN的缺失增加了免疫抑制细胞因子的表达,降低了T细胞效应因子IFN-γ的表达,导致抑制T细胞介导的浸润和免疫。在获得性耐药的病例中也观察到PTEN的丢失。
类似于PTEN丢失,WNT-β-catenin活性与免疫抑制细胞因子的产生、树突状细胞启动的改变、调节性T细胞的促进以及黑色素瘤中T细胞浸润的缺乏有关,支持β-catenin在ICI抵抗中的作用。

其它抑制检查点
一些报告描述了获得性耐药时其他T细胞检查点的上调表达,包括TIM3、LAG3和VISTA。尽管这些检查点在某些情况下可能在功能上与T细胞衰竭和终末期功能障碍有关,但它们也可能与T细胞活化有关。因此,可能需要额外的数据来理解这些例子中的功能性T细胞状态,以及最终对获得性耐药的贡献。

ICI获得性耐药机制研究的挑战
研究免疫治疗获得性耐药的机制存在诸多挑战,主要挑战包括:
1. 缺乏用于定义、分类和应用获得性耐药的统一标准;
为了分析和解释多重研究的结果,应建立明确一致的界定获得性耐药的框架。例如,在EGFR突变型肺癌中,制定了相对简单但具体的指导方针,以定义获得性耐药患者。规定的EGFR标准应具有1)记录对治疗的初始客观响应或显著且持久的(大于6个月)临床收益;以及2)在EGFR-TKI持续治疗期间的最后30天内出现疾病的全身进展。这些标准似乎很简单,不言而喻,但确实有助于对评估新的治疗方法在耐药性和机制方面保持一致性。而对于免疫治疗的获得性耐药,目前尚无这样的统一定义。
2. 难以获得最佳的肿瘤样本进行分析;
与分子靶向治疗相比,对ICI的响应更低,而对ICI获得性耐药的发生更为特殊。例如,在EGFR突变型肺癌中,约80%的患者接受osimertinib治疗后最初会有应答,几乎所有应答者最终都会产生获得性耐药性。在这种情况下,常规收集治疗前组织是合理有效的。
然而,对于ICIs,一开始对治疗敏感的患者比例要小得多,而且在那些确实有反应的患者中,获得性耐药的发展是可变的。因此,在对获得性耐药特别感兴趣的研究中,在基线时收集所有患者的组织是非常低效的。总的来说,对ICIs的后天耐药的更不可预测性使得设计和执行成功的相关研究变得困难。
3. 缺乏常规、有效的工具来全面探究和发现肿瘤免疫耐药机制;
在靶向治疗分析中,使用大量的新一代DNA和RNA测序已经成功地确定了获得性耐药的主要驱动因素。然而,同样集中在肿瘤样本的大量DNA和RNA测序上,对ICIs耐药性的研究仅发现了有限数量的获得性基因改变。相反,对ICI的耐药性可能更为微妙、动态和复杂,至少涉及三种相互作用(宿主、肿瘤、肿瘤微环境)和两个部分(肿瘤内和全身),因此需要对肿瘤和免疫细胞在遗传学、功能状态以及空间联系等多方面进行更高分辨率的研究。
小结
ICI的获得性耐药是一种常见的临床表型,对其机制的研究受到诸多障碍,研究相对较少。只有通过深入了解基础生物学,允许免疫检查点抑制剂以外的免疫治疗方法的精确部署,才能获得更有效的治疗策略。这需要我们协同努力克服重重障碍,以加深对获得性抗ICI的内在生物学的了解。这一进展最终将发展出未来更合理的药物和细胞治疗,以防止、规避或逆转对ICI的耐药性。
参考文献:
1.Acquired Resistance to Immune Checkpoint Inhibitors. Cancer Cell. 2020 April 13; 37(4): 443–455.
原文标题:免疫检查点抑制剂的获得性耐药机制
-
检查点PD-1生物学的新见解
2022-06-20 -
免疫检查点抑制剂的慢性免疫毒性
2022-02-09 -
脂肪生成抑制剂药物开发的机遇与挑战
2022-01-20 -
新型免疫检查点抑制剂的临床观察
2021-09-22 -
免疫检查点抑制剂的外周血生物标志物
2021-09-17 -
免疫检查点的配体
2021-09-16