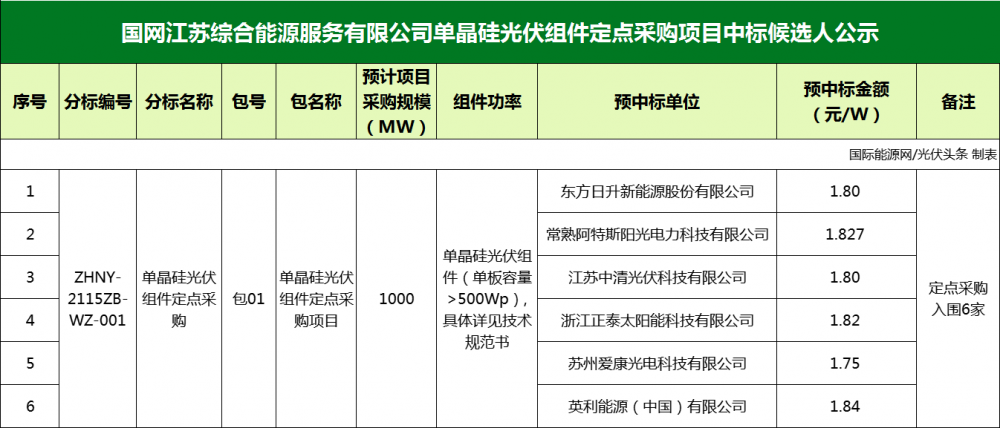
脂肪生成抑制剂药物开发的机遇与挑战
关注小药说药,一起成长!
前言
脂肪酸是细胞生存所必需的,其作为生物能量基质、结构成分和信号分子发挥作用。鉴于它们的重要作用,细胞已经进化出从替代碳源生成脂肪酸的机制,通过一个称为从头脂肪生成(DNL)的过程。
尽管DNL对维持全身和细胞内环境稳定至关重要,但其慢性升高与多种疾病和紊乱的发展相关,包括心血管疾病(CVD)、非酒精性脂肪肝(NAFLD)、2型糖尿病(T2D)、多种癌症、病毒感染、自身免疫性疾病和神经退行性变。因此,抑制DNL的核心酶,包括柠檬酸/异柠檬酸载体(CIC)、ATP柠檬酸裂解酶(ACLY)、乙酰辅酶A羧化酶(ACC)和脂肪酸合成酶(FAS),是一种非常有吸引力的治疗策略。
目前,已发现多种DNL抑制剂的天然产物,其中一些化合物已进入到临床开发阶段,并已被批准用于治疗高脂血症,或已进入NAFLD和肿瘤学的后期开发阶段。
DNL酶的生理和病理作用
DNL的生理调节作用很复杂,不同的细胞类型和营养状况有很大差异。
能量平衡
DNL途径的活动似乎可以调节能量的摄入和消耗。例如,缺乏Fas的老鼠减少了食物摄入量,而缺乏Acc的老鼠增加了食物摄入量。从机理上讲,FAS和ACC对食物摄入的不同影响可以通过对丙二酰辅酶A的不同影响来解释。丙二酰辅酶A抑制食物摄入:FAS抑制增加丙二酰辅酶A,而ACC抑制降低丙二酰辅酶A。
脂质沉积:NAFLD–NASH
NAFLD患者的DNL发生率增加,这是导致脂质沉积增加的主要因素。与这些观察结果一致,NAFLD或非酒精性脂肪性肝炎(NASH)患者肝脏中CIC、ACLY、ACC和FAS的表达增加。在喂食高脂饮食(HFD)的小鼠中,Slc25a1基因的肝脏特异性缺失可降低肝脏脂肪变性。在喂食高碳水化合物饮食的ob/ob小鼠中,使用小干扰RNA(siRNA)对ACLY的短暂遗传抑制可降低肝脏脂质含量。
胰岛素敏感性:T2D
胰岛素抵抗是T2D的特征。在人类中,肝脏中DNL的比率与肝脏和全身胰岛素敏感性呈负相关,Slc25a1的肝脏特异性缺失可改善小鼠的糖耐量。在喂食高碳水化合物饮食的ob/ob小鼠中,siRNA介导的ACLY表达抑制可降低空腹血糖并改善糖耐量。这些数据表明,抑制DNL和/或上调小鼠肌肉和肝脏内的脂肪酸氧化可提高胰岛素敏感性。
心血管疾病
肝脏DNL升高导致血浆VLDL和LDL升高,这是心血管疾病致死的主要危险因素。最近的研究发现,突发性心力衰竭和CVD死亡率与DNL脂肪酸的增加呈正相关。与此相一致,ACLY中的基因变异与血浆LDL降低和心血管事件减少相关。
癌症
DNL在许多癌细胞中具有组成性活性,并贡献了大部分细胞内脂质。现在人们已经认识到,常见的基因突变(例如,编码p53或PTEN的基因)和生长因子信号增强SREBP1的活性,从而导致产脂基因的上调。除了转录控制外,糖酵解肿瘤中常见的葡萄糖摄取增强增加了柠檬酸盐的利用率,从而变构激活ACLY和ACC。因此,肿瘤可使用多种重叠机制来增强DNL。
抑制DNL会增加对标准治疗的敏感性,如放射治疗、雄激素缺乏化疗或酪氨酸激酶抑制剂。抑制DNL可能对多种类型的癌症产生有利影响。
感染与免疫
炎症和新陈代谢密切相关,因为维持细胞防御系统和清除病原体是一个需要能量的过程。在这个过程中发生的代谢开关之一是DNL的诱导。众所周知,具有促炎作用(M1样)的免疫细胞使用有氧糖酵解并具有较高的DNL率,而抗炎免疫细胞(M2样)主要使用氧化代谢并具有较低的DNL率。
ACC和ACLY都调节免疫功能。在一些研究中,阻断ACLY抑制了LPS诱导的炎症,并且对于介导IL-4和IL-2的抗炎作用非常重要。这些研究表明,抑制DNL可能有效地减少慢性疾病如肥胖和NASH的炎症,并可能对减少病毒复制产生积极影响。
神经发生
神经分化贯穿一生,与神经干细胞和祖细胞中DNL的上调密切相关。FAS和ACC的失活降低了神经分化,这与神经退行性疾病有关,包括多发性硬化、帕金森病和阿尔茨海默症。
柠檬酸/异柠檬酸载体(CIC)
CIC由SLC25A1基因编码,在全身广泛表达,在肝脏、生殖器官、胃肠道和脂肪组织中表达最高。它位于线粒体内膜内,主要催化柠檬酸盐和异柠檬酸盐等三羧酸盐以交换三羧酸根、二羧酸根和磷酸烯醇式丙酮酸。LCFA-CoA以可逆方式抑制CIC,与柠檬酸盐竞争,而乙酰化可增加柠檬酸盐的变构激活。
在结构上,真核生物CIC由三个同源结构域组成,每个结构域形成两个疏水跨膜α-螺旋,由亲水环连接,至少有两个柠檬酸结合位点,位于跨膜区的不同位置,作为CIC抑制剂的结合位点。

CTPI-2是一种新一代竞争性CIC抑制剂,亲和力比第一代的CTPI-1提高了20倍,并且可以在较低浓度下抑制柠檬酸盐的转运。
NASH患者的肝脏中CIC表达增加,CTPI-2治疗HFD喂养的小鼠可逆转脂肪性肝炎和肝损伤,同时降低血清胆固醇和甘油三酯。抑制CIC可能对肥胖、NAFLD和T2D产生有利影响。此外,由于CIC在几种不同的癌细胞中表达增加,并且抑制CIC会减缓细胞生长,CIC已成为抗癌药物开发的一个有吸引力的靶点。
ATP柠檬酸裂解酶(ACLY)
ACLY在脂肪和肝脏中表达最高,在骨骼肌中表达最低。尽管ACLY主要是一种胞浆酶,但它也存在于细胞核内。ACLY的激活包括四个步骤:首先,Mg–ATP结合导致His760的磷酸化,其催化形成酶结合的柠檬酰磷酸酯,随后CoA攻击形成柠檬酰CoA中间体,最后,柠檬酰CoA裂解为最终产物乙酰CoA和草酰乙酸(OAA)。
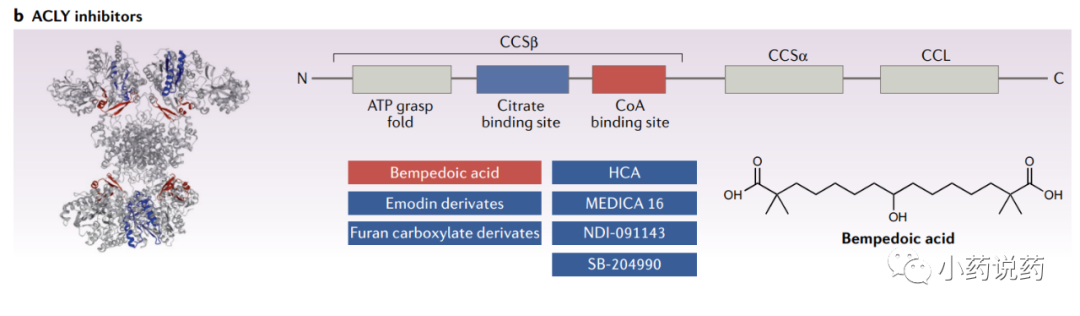
ACLY是一个有吸引力的药物靶点,因为它在脂肪酸、胆固醇和碳水化合物代谢的关系中具有战略地位。
首次发现并广泛研究的ACLY抑制剂是(?)-羟基柠檬酸(HCA),一种柠檬酸的衍生物,发现于热带植物藤黄和木槿中。另外,几种基于靶向策略设计的合成抑制剂,旨在破坏与活性位点结合的稳定的柠檬酰辅酶a中间体的形成。
MEDICA 16是最早合成的类似脂肪酸的ACLY抑制剂之一。MEDICA 16在几种不同的肥胖诱导胰岛素抵抗啮齿动物模型中降低了肝脏脂质含量、肝脏葡萄糖生成,并改善外周胰岛素敏感性。此外,动物模型的早期研究证明了MEDICA 16对循环胆固醇和甘油三酯水平的广泛降脂作用,以及对血管和心肌病变的相关有益作用。
乙酰辅酶A羧化酶(ACC)
在哺乳动物中,ACC有两种亚型,ACC1(也称为ACCα)和ACC2(也称为ACCβ)。ACC1广泛表达,而ACC2主要存在于骨骼肌、乳腺、脂肪和肝脏。ACC酶由三个结构域组成(BC、 BCCP和CT),它们在包括哺乳动物在内的大多数真核生物中组装成单链。
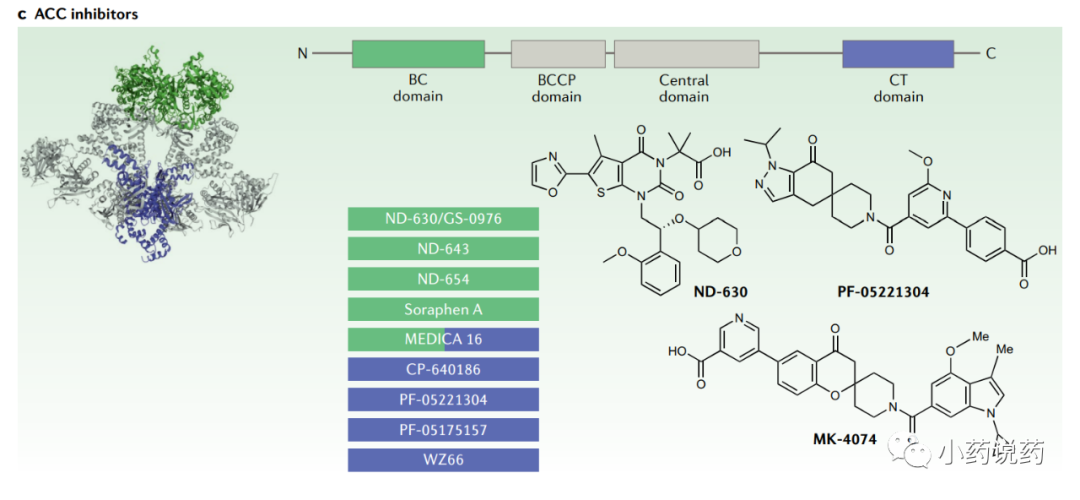
抑制ACC可以降低丙二酰辅酶A,丙二酰辅酶A也是肉碱棕榈酰转移酶1的变构抑制剂,肉碱棕榈酰转移酶1是控制脂肪酸进入线粒体进行β-氧化的限速酶。因此,ACC抑制是同时抑制DNL和增加脂肪酸氧化的一种有吸引力的方法。
目前,一些ACC抑制剂已进入人体临床试验。辉瑞开发了PF-05221304,作为一种选择性、口服生物利用度和可逆的ACC抑制剂,优先分配到肝脏,从而避免了与抑制血小板形成和发育缺陷相关的潜在毒性。在NAFLD的II期临床试验中,PF-05221304在最高剂量下剂量依赖性地降低肝脏脂肪达65%,同时降低了HbA1c。
与结合到CT结构域的PF-05221304相反,Nimbus Therapeutics开发了几种结合到BC结构域的ACC抑制剂。ND-630,也称为GS-0976(Firsocostat),已进入临床开发阶段。在一项开放标签的非安慰剂对照研究中,经ND-630治疗的NASH患者在治疗12周后,肝脏DNL中位数下降22%,肝脏脂肪和肝脏硬度显著降低。在随后的一项较大的随机、安慰剂对照研究中,ND-630治疗使肝脏脂肪变性减少了21%。ND-630和GLP1R激动剂Semalutide的II期研究目前正在进行中。
脂肪酸合成酶(FAS)
人类FAS在脂肪组织和生殖器官中高度表达。FAS在结构和功能上已经进化出不同的变体,根据催化单元的组织结构,通常分为两种类型——1型和2型FAS。在真核生物中,1型FAS多功能复合物在细胞质中表达,仅受一个基因调控。2型FAS存在于线粒体中,其功能完全独立于1型FAS。1型FAS通常只生成棕榈酸酯,而2型FAS能够生成多种脂肪酸,包括不饱和脂肪酸。
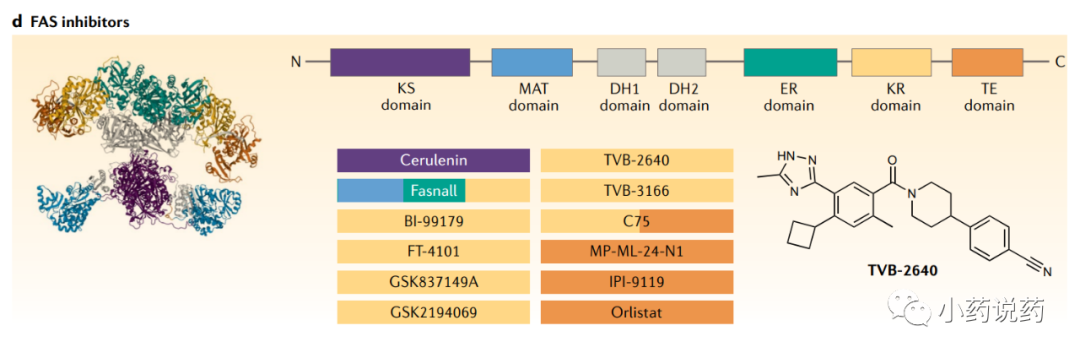
一些新的小分子FAS抑制剂已经被开发出来,可以抑制TE结构域。Orlistat,也称为四氢脂他汀,是脂他汀的衍生物,通过与TE结构域不可逆结合,可以抑制FAS。靶向KR结构域的FAS抑制剂也已开发出来,一些最近已进入临床试验,包括GSK的GSK2194069、勃林格殷格翰的BI-99179以及Sagimet Biosciences开发的TVB-3166和TVB-2640等。
早期研究表明,在肥胖和胰岛素抵抗的个体中,TVB-2640可以将DNL降低90%。目前正在对NASH患者进行II期临床研究。此外,Orlistat在肿瘤细胞中表现出细胞抑制和细胞毒性作用,纳米颗粒技术已用于提高其生物利用度和细胞毒性。GSK2194069和TVB-3166也在几种不同的临床前模型中抑制癌细胞增殖。
DNL抑制剂的挑战
在过去的50年里,在理解DNL在调节细胞代谢和全身能量平衡方面的生化机制和生理意义方面取得了巨大进展。然而,新一代高选择性和高效小分子药物的开发和测试也揭示了一些令人惊讶的新生物学见解,这些见解对安全性、有效性和进入临床试验的联合疗法的必要性具有重要意义。
安全相关副作用
抑制DNL有几个安全性问题。第一个也是最重要的是与胚胎发育有关的毒性,ACLY、ACC1或FAS缺陷小鼠在胚胎发育过程中死亡,而CIC缺陷以严重的神经发育障碍为特征。ACC抑制剂PF-05175157还可诱导大鼠和兔的发育毒性,因此,避免DNL的系统性抑制对于保护胚胎发育至关重要。
抑制肝脏和脂肪组织等产脂器官中DNL的另一个主要问题是,这只是将碳重新定向到身体其他部位,而这些部位的毒性可能更大。ACC抑制剂MK-4074首次建立了这种作用的实验证据,其剂量依赖性地增加SREBP1c和血清甘油三酯,随后对NASH患者进行的ND-630和PF-05221304的研究显示了类似的效果。而PF-05221304增加的血清甘油三酯可通过联合施用DGAT2抑制剂加以抑制,通过激活AMPK抑制ACC可降低血清甘油三酯和胆固醇效应。因此,更好地理解这些抑制肝脏DNL的差异反应背后的机制对于缓解潜在的不良事件非常重要。
此外,还必须考虑与DNL途径不同步骤的阻断相关的上游和下游后果,导致代谢中间产物的积累。例如,FAS的抑制导致丙二酰辅酶a的生成。FAS抑制导致的丙二酰辅酶a的增加通过mTOR的丙二酰化损害生理和病理血管生成。丙二酰化还涉及各种代谢途径、组蛋白修饰和免疫细胞重编程,这表明FAS抑制可能比预期的DNL抑制表现出更广泛的生物学效应。因此,当开发DNL抑制剂作为治疗方法时,考虑代谢中间体的影响是非常关键的。
DNL抑制/代偿途径
细胞代谢的灵活性是DNL抑制剂的另一个关键关注点。新陈代谢是流动的和相互联系的,一条途径中的一个障碍增强了通过其他途径的流量。例如,在缺氧条件下,由于葡萄糖到乙酰辅酶A的通量减少,KRAS突变已被证明为癌细胞提供了更高的清除外源性脂质的能力,从而减少了对DNL的依赖。这表明,根据所涉及的营养背景和细胞类型,DNL抑制剂要高效,可能还需要针对代偿机制。例如,对于正在接受ACLY抑制剂治疗的患者来说,限制他们的酒精和果糖摄入量以最大限度地提高疗效是否很重要?或者,使用FAS抑制剂治疗癌症的患者是否需要限制高脂肪食物?
全身/器官特异性抑制
DNL抑制剂临床开发的一个重大挑战是发现啮齿动物和人类之间某些细胞的差异反应。系统性ACC抑制剂PF-05175157的临床开发就是一个例子,该抑制剂对啮齿动物没有毒性,但对人的剂量递增研究显示血小板计数减少。随后的研究证实血小板计数的减少是由于骨髓内的ACC抑制,这损害了巨核细胞的成熟。
新一代肝靶向ACC抑制剂ND-630和PF-05221304避免了这种效应。类似地,肌肉和脂肪组织中ACLY的遗传抑制分别导致肌肉无力和脂肪营养不良,而FAS抑制与脱发有关,新一代肝导向ACLY和FAS抑制剂降低了这种作用。因此,迄今为止的数据表明,通过肝靶向可以安全地抑制FAS、ACC和ACLY;然而,是否能安全地在其他器官或细胞类型中长期抑制DNL仍需要进一步研究。
小结
在过去的十年中,脂肪生成抑制剂已进入癌症、心血管疾病、NASH等疾病的临床开发。这些DNL抑制剂已经在临床前和临床研究中看到了治疗这些疾病的潜力。未来如何平衡疗效和安全性,是DNL抑制剂开发亟需解决的问题,因为增强效力可能导致更大的代偿性上调或毒性。
而最终,DNL抑制剂是否安全有效,足以作为单一疗法使用,或将与其他疗法联合使用,将取决于临床试验结果。在这方面,ACLY抑制剂苯丙烯二酸的研究结果令人鼓舞,它们表明,当单独使用或与其他护理标准一起使用时,肝脏中DNL的慢性抑制是安全的。这也给了我们开发DNL抑制剂的更多的信心,它们可能成为新一类治疗的基础。
参考文献:
1. Lipogenesis inhibitors: therapeutic opportunities and challenges. Nat Rev Drug Discov. 2022 Jan 14 : 1–23.

-
ADC药物的内吞机制研究
2021-09-22 -
新型免疫检查点抑制剂的临床观察
2021-09-22 -
免疫检查点抑制剂的外周血生物标志物
2021-09-17 -
拜耳收购 Vividion 强化药物发现平台
2021-08-09 -
博瑞医药宣布开展ADC药物的CDMO服务
2021-07-22 -
AI+药物研发,会给市场带来怎么的期待?
2021-06-29 -
3D打印药物企业三迭纪获3.3亿元B轮融资
2021-06-23